| Home |
| Weitere Links: |
| |
Empfehlung der GD: Wirkstoffdossiers für externe dermatologische Rezepturen
in der Fassung vom
25.06.2007
PDF-Version

Präambel - Zu den Grundforderungen an Arzneimittel einschließlich der Rezepturen zählen Wirksamkeit, Unbedenklichkeit und pharmazeutische Qualität. Die Individualrezeptur erfordert insofern detaillierte galenische und pharmakologische Kenntnisse,weil überwiegend Mehrphasensysteme vorliegen, deren Stabilität und Wirksamkeitüber den Anwendungszeitraum schwierig zu beurteilen sind. Dies gilt insbesondere für nichtstandardisierte Rezepturen und Wirkstoffkombinationen. Die vorliegendeEmpfehlung berücksichtigt schwerpunktmäßig die in der allgemein zugänglichen Fachliteratur zur Verfügung stehenden Daten für dieStandardsituation in der Praxis. Wesentliche Bedeutung kommen in diesem Zusammenhang dem Qualitätsmanagement entsprechend der GD-Leitlinie „Dermatologische Rezeptur“ und den Empfehlungen der Deutschen Dermatologischen Gesellschaft (DDG) zu.Leitlinien und Empfehlungen bedürfen der regelmäßigen Überprüfung und gegebenenfalls der Änderung im Hinblick auf denwissenschaftlichen Erkenntnisstand und derpraktischen Relevanz.
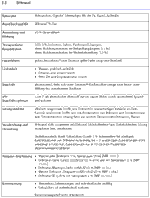
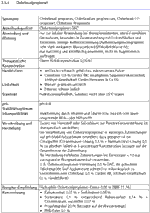
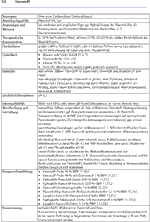
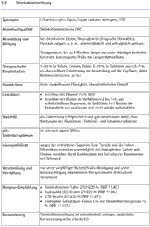
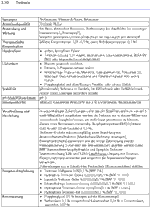
1 Definition Wirkstoffdossier - Unter "Wirkstoffdossier" im Sinne dieser Empfehlung werden praxisorientierte Angaben zu Wirkstoffen verstanden, die derzeit am häufigsten in externen dermatologischen Rezepturen verordnet werden. Die relevanten chemischen, physikalischen und galenischenEigenschaften sind in tabellarischer Übersicht zusammengestellt; anwendungsorientierte Informationen eingeschlossen. Die Auswahl der Stoffe für die Erstellung der Wirkstoffdossiers erhebt keinen Anspruch auf Vollständigkeit.
2 Zielgruppe und Zweck - Die Empfehlung richtet sich an Ärzte und Apotheker. Im Sinne der Qualitätssicherung dient sie zur Information und als Vorschlag bei der ärztlichen Verschreibung dermatologischer Rezepturen und deren Herstellung in der Apotheke. Sie fördert die rationale Rezeptur und soll die Kommunikation zwischen Arzt und Apotheker erleichtern. Die erforderliche galenische Qualität und Stabilität der Rezeptur sollen einfach und sicher beurteilt werden können.
3 Qualität der Bestandteile - Die arzneimittelrechtlich erforderliche Qualität der Rezepturbestandteile muss vom Apotheker festgestellt und belegt werden. Grundsätzlich dürfen deshalb nur mit einem Prüfzertifikat gemäß §§ 6 und 11 ApBetrO oder mit vollständiger apothekeneigener Qualitätsdokumentation versehene Grundstoffe und Zubereitungen, verkehrsfähige Fertigarzneimittel oder in der Apotheke nach den anerkannten pharmazeutischen Regeln hergestellte Stoffe und Zubereitungen in Rezepturen verschrieben, verarbeitet und in Verkehr gebracht werden.
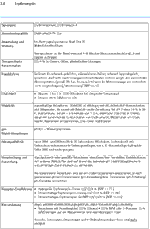
Anwendung und Wirkung: Ausschließlich bei topischer Anwendung in der Dermatologie.
Arzneibuchqualität: Monographie-Titel derjeweils gültigen Arzneibücher. Nach §§ 6 und 11 ApBetrO müssen Rezepturen mit Ausgangsstoffen hergestellt werden, die nachweislich die erforderliche Qualität haben.
Handelsform: Beschreibung und Spezifikation der Substanz in Pharmaqualität, die im pharmazeutischen Großhandel zur Zeit erhältlich ist. Einbezogen sind Rezepturkonzentrate, beziehungsweise Stammverreibungen und deren Bezugsquellen.
Inkompatibilität: Unverträglichkeiten zwischen zwei oder mehreren Bestandteilen eines Dermatikums. Sie können chemische, physikalisch-chemische oder mikrobiologische Ursachen haben. Bei freien Rezepturen sind ohne sichere Kenntnis der Einzelkomponenten Inkompatibilitäten zwischen Arzneistoffen oder Hilfsstoffen oder zwischen Arzneistoff und Hilfsstoff möglich. Inkompatibilitäten sind oft konzentrationsabhängig.
Konservierung: Hinweise zur Konservierung einer mikrobiell anfälligen wasserhaltigen Zubereitung unter Berücksichtigung der Wirksamkeit und Verträglichkeit des Konservierungsmittels mit den übrigen Rezepturbestandteilen.
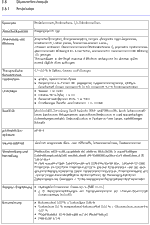
Löslichkeit:
Die Menge eines Stoffes, die sich in einer bestimmten Menge eines Lösungsmittelbis
zum Erreichen der temperaturabhängigen Löslichkeitsgrenze löst.
Löslichkeitsangaben werden unter Berücksichtigung der für die dermatologische
Rezeptur relevanten Lösungsmittel und Grundlagen als Masseteil in Gramm für
die Substanz und ungefähre Anzahl Volumenteile Lösungsmittel in Milliliter
angegeben.
Die Bezeichnung der Löslichkeit richtet sich nach den
Löslichkeitsangaben des gültigen Arzneibuchs bezogen auf Raumtemperatur
von15 bis 25 °C:
![]() sehr leicht löslich: 1 g in weniger als 1 ml
sehr leicht löslich: 1 g in weniger als 1 ml
![]() leicht löslich: 1 g in 1 bis 10 ml
leicht löslich: 1 g in 1 bis 10 ml
![]() löslich: 1 g in über 10 bis 30 ml
löslich: 1 g in über 10 bis 30 ml
![]() wenig löslich: 1 g in über 30 bis 100 ml
wenig löslich: 1 g in über 30 bis 100 ml
![]() schwer löslich: 1 g in über 100 bis 1000 ml
schwer löslich: 1 g in über 100 bis 1000 ml
![]() sehr schwer löslich: 1 g in über 1000 bis 10 000 ml
sehr schwer löslich: 1 g in über 1000 bis 10 000 ml
![]() praktisch unlöslich: 1 g in mehr als 10 0000 ml
praktisch unlöslich: 1 g in mehr als 10 0000 ml
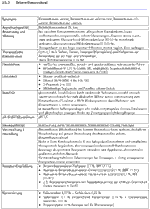
Obere Richtkonzentration: Die Angaben zur oberen Richtkonzentration sind als Empfehlung einschlägiger Leitlinien anzusehen und entsprechen dem anerkannten Stand der pharmazeutischen Wissenschaften. Ihre Beachtung ist nicht unmittelbar rechtsverbindlich, dennoch hat dieAngabe zur oberen Richtkonzentration normativen Charakter. Die Überschreitung kann therapeutisch begründet sein. Der Arzt soll dann seine Absicht durch einen Vermerk kenntlich machen. Fehlt ein solcher Vermerk, soll die Apotheke die Konzentrationsüberschreitung als Unklarheit werten und vor der Herstellung mit dem Arzt Rücksprache nehmen.
pH-Stabilitätsoptimum: pH-Wert, bei dem die Stabilität des Wirkstoffes in der wasserhaltigen Zubereitung über einen längeren Zeitraum zu erwarten ist.
Stabilität: Stabilität der Rezeptursubstanz sowie Konstanz des Wirkstoffgehaltes in der galenischen Zubereitung unter variierenden Bedingungen
Synonyme: Andere pharmazeutische oder chemische Bezeichnungen für den Wirkstoff. Die Wirkstoffdossiers berücksichtigen vorrangig die in der Praxis geläufigen pharmazeutischen Namen.
Therapeutische Konzentration: Der üblicherweise in der Dermatologie verwendete Konzentrationsbereich. Die obere therapeutische Richtkonzentration ist für ausgewählte dermatologische Arzneistoffe aufgeführt und soll versehentlich zu hohe Dosierungen hinterfragen helfen.
Rezeptur-Empfehlung: Hinweise auf standardisierte Vorschriften aus DAB, DAC und NRF, die bevorzugt verordnet und hergestellt werden sollen.
Bei regelmäßig aktualisierten Werken ist die jeweils geltende Fassung zu berücksichtigen.
(1)
Albert, K., Lagerungszeiten von Arzneistoffen, Hilfsstoffen, Drogen und Drogenzubereitungen,
2. Auflage, Govi-Verlag Pharmazeutischer Verlag, Eschborn 2005.
(2) Altmeyer,
P., Bergmeyer, V., Wienand, W., Analyse magistraler Rezepturen von niedergelassenen
Dermatologen, Hautarzt 48 (1997) 17–20.
(3) Altmeyer, P., Therapielexikon.
Dermatologieund Allergologie. Springer Verlag, Berlin, Heidelberg, New York 1998.
(4) AMK-Information 2/1/2/98, Erythromycin: Stabilität in Rezepturarzneimitteln,
Pharm. Ztg.143 (1998) 92–93.
(5) Arzneibuch-Kommentar. Wissenschaftliche
Erläuterungen zum Europäischen Arzneibuchund zum Deutschen Arzneibuch,
Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart / Govi-Verlag Pharmazeutischer
Verlag, Eschborn.
(6) Bundesapothekerkammer, Leitlinien zur Qualitätssicherung.
Herstellung und Prüfung dernicht sterilen Rezeptur- und Defekturarzneimittel,
Revision 6.5.2003,
www.abda.de/ABDA/download/Qualitaetssicherung/Nicht sterile
Rez.pdf.
(7) Bundgaard, H., Hansen, J., Studies on the stability of corticosteroids.
VI. Kinetics of there arrangement of Betamethasone-17-valerateto the 21-valerate
ester in aqueous solution ,Int. J. Pharm. 7 (1981) 197–203.
(8) Deutscher
Arzneimittel-Codex (DAC), Bundesvereinigung Deutscher Apothekerverbände (Hrsg.),
Govi-Verlag Pharmazeutischer Verlag, Eschborn / Deutscher Apotheker-Verlag,Stuttgart.
(9) Eifler-Bollen, R., Lein, A., Reimann, H., Arzneimittelherstellung. Qualität
von Rezepturen steuern, Pharm. Ztg. 148 (2003) 4098–4105.
(10) Folia
Ichthyolica: Dermatologische Rezepturen, Ichthyol-Gesellschaft, www.ichthyol.de.
(11) Formularium der Nederlandse Apothekers, Wetenschappelijke Instituut Nederlandse
Apothekers (WINAp), Koninklijke NederlandseMaatschappij ter bevorderung der Pharmacie(Hrsg.
und Verlag), Den Haag 2004.
(12) Formularium hospitale, Herstellungsvorschriften
aus Krankenhausapotheken., ADKAService-Abteilung (Hrsg.).
(13) Garbe, C.,
Reimann, H., Rationelle Dermatologische Rezeptur, 2. Auflage, Georg ThiemeVerlag
in Kooperation mit Govi-Verlag, Stuttgart2005.(14) Gloor, M., Dermatokortikosteroide
(DKST).In: Gloor, M., Thoma, K., Fluhr, J. (Hrsg.), Derma-tologische Externatherapie,
Springer Verlag, Berlin, Heidelberg, New York 2000, S. 299–324.
(15)
Hünerbein, B., Eifler-Bollen, R., Dermatologische Rezepturen, Leitlinie der
GD Gesellschaftfür Dermopharmazie, Bonn 2003, www.gd-online.de; nachgedruckt
in NRF-Text I.6.1.
(16) Hunnius, Pharmazeutisches Wörterbuch 9.Aufl.,
de Gruyter-Verlag 2004.
(17) Korting, H. C., Sterry, W. (Hrsg.), Therapeutische
Verfahren in der Dermatologie – Dermatika und Kosmetika, Blackwell Wissenschafts-Verlag,
Berlin und Wien 2001.
(18) Meigel, W. N., Altmeyer, P., Jahn, S., und die
DDG-Kommission „Magistrale Rezepturen” ,Empfehlungen zu „Magistralen
Rezepturen”erarbeitet, Hautarzt 48 (1997) 702.
(19) Müller, R.,
et al., Stabilität von Cignolin(Dithranol) in teerhaltigen Salben mit und
ohneSalicylsäurezusatz, Hautarzt 38 (1987) 107–111.
(20) Neues
Rezeptur-Formularium (NRF),Bundesvereinigung Deutscher Apotheker-verbände
(Hrsg.), Govi-Verlag Pharmazeutischer Verlag, Eschborn / Deutscher Apotheker-Verlag,Stuttgart.(21)
Niedner, R., Grundlagen einer rationalenTherapie mit externen Glukokortikosteroiden,Hautarzt
42 (1991) 337–346.
(22) Niedner, R., Ziegenmeyer, J. (Hrsg.), Dermatika,
Wissenschaftliche Verlagsgesellschaft,Stuttgart 1992.
6 Verfahren zur Konsensbildung
Erarbeitet
von
![]() Apothekerin
R. Eifler-Bollen, Eschborn
Apothekerin
R. Eifler-Bollen, Eschborn
![]() Apotheker Dr. B. Hünerbein, Naumburg
Apotheker Dr. B. Hünerbein, Naumburg
![]() Apothekerin Dr. U. Schöffling, Trier
Apothekerin Dr. U. Schöffling, Trier
![]() Apotheker Dr. G. Wolf, Grafschaft-Ringen
Apotheker Dr. G. Wolf, Grafschaft-Ringen
Unter Mitarbeit von
![]() Prof. Dr. med. R. Niedner, Potsdam
Prof. Dr. med. R. Niedner, Potsdam
![]() Apotheker Dr. H. Reinhardt, Offenbach
Apotheker Dr. H. Reinhardt, Offenbach
![]() Apotheker W. U. Michaelis, Freiburg
Apotheker W. U. Michaelis, Freiburg
Die Empfehlung wurde im Auftrag der GDGesellschaft für Dermopharmazie von der obengenannten Expertengruppe als Konsensuspapiererarbeitet.
Zur Veröffentlichung freigegeben: 7. Juni 2005
Überprüfung geplant: Juni 2008
Copyright
© 2000 - 2025
Institute for Dermopharmacy GmbH
webmaster@gd-online.de
Haftungsausschluss