| Home |
| Weitere Links: |
| |
Etablierte
Indikationen von TIMs
Klinik für Haut- und Allergieerkrankungen
der Universität Helsinki, Helsinki, Finnland
Die
einzige zugelassene Indikation für die topischen Immunmodulatoren ist die
Atopische Dermatitis (AD) oder Neurodermitis, für Tacrolimus-Salbe die mittelschwere
und schwere Form der AD und Pimecrolimus für leichte und mittelschwere Fälle.
Mit Tacrolimus-Salbe wurden vergleichbare Studien mit Kindern (ab 2 Jahren)
und mit Erwachsenen (ab 16 Jahren) durchgeführt, wobei in allen Studien Tacrolimus-Salbe
als Monotherapie angewendet wurde. Zusammenfassend kann gesagt werden, dass Tacrolimus-Salbe
in allen getesteten Konzentrationen (0,03 %, 0,1 %, 0,3 %) dem Placebo stets deutlich
signifikant überlegen war (1-4). Diese Studien hatten eine Dauer zwischen
3 und 12 Wochen. Die in den USA durchgeführten Studien konnten im Gegensatz
zu den europäischen Studien keinen signifikanten Unterschied zwischen der
0,03%igen und der 0,1%igen Formulierung nachweisen. In europäischen Studien
war die Tacrolimus-Salbe 0,1 % der 0,03%igen Formulierung deutlich überlegen.
Daher wurde von der Zulassungsbehörde FDA in den USA für Kinder nur
die schwächere Tacrolimus-Salbe 0,03 % zugelassen. Die europäische Zulassungsbehörde
EMEA ist diesem Entwurf leider gefolgt.
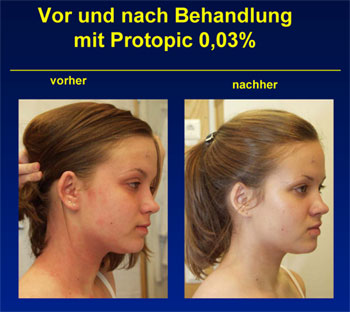
Tacrolimus-Salbe 0,03 % ist für mittelschwere Formen der Erkrankung
hinreichend. Bessere Behandlungserfolge in den schweren Formen wurden mit der
0,1%igen Formulierung erzielt. Dementsprechend zeigte eine einmal tägliche
Behandlung von Kindern vergleichbare Ergebnisse bei mittelschweren Formen. Bei
den eher schweren Formen der AD war die einmal tägliche Anwendung weniger
wirksam.
Im Vergleich zu einer topischen Standardtherapie mit Kortikosteroiden zeigte die Tacrolimus-Salbe 0,1 % in Kurzzeitstudien über drei Wochen ein vergleichbares Potential zu Hydrocortisonbutyrat 0,1 %, einem mittelstark wirksamen Kortikosteroid (5). Tacrolimus-Salbe 0,03 % war dem Hydrocortisonacetat 1 %, einem schwach wirksamen Kortikosteroid überlegen (6). In einer Studie über sechs Monate, bei der die Studienmedikation intermittierend bei Bedarf angewendet wurde, zeigte sich Tacrolimus-Salbe 0,1 % der Therapie mit Kortikosteroiden signifikant überlegen (Hydrocortisonacetat 1 % für Gesicht und Hals, Hydrocrotisonbutyrat 0,1 % für den restlichen Körper).
Bei allen Studien war die systemische Exposition gering, und es konnten keine klinischen Zeichen einer systemischen Immunsuppression nachgewiesen werden (7). Eine häufige unerwünschte Arzneiwirkung besteht in einem initialen Brennen an der Applikationsstelle, das bei etwa 50 % der erwachsenen Patienten beobachtet werden kann. Bei Kindern ist dieser Anteil geringer. Gelegentlich kommt es auch zu einer Verstärkung des Juckreizes. Diese Nebenwirkungen sind nur in den ersten Behandlungstagen zu beobachten. Im Vergleich mit der Placebogruppe konnte keine erhöhte Rate an Infektionen verzeichnet werden (8). Bei vergleichenden Studien gab es einen leichten Anstieg bei Infektionen mit Herpes simplex während der ersten Behandlungswoche. Bei längeren Behandlungsperioden war dieser Unterschied zwischen den Behandlungsgruppen nicht mehr nachweisbar. Im Gegensatz zu Kortikosteroiden konnte eine Atrophie der Haut nicht nachgewiesen werden. Bei vorgeschädigter Haut, bei der es durch Anwendung von Kortikosteroiden zu einer Verdünnung gekommen war, wurde eine allmähliche Normalisierung der Hautdicke unter Behandlung mit Tacrolimus-Salbe nachgewiesen.
Für die Pimecrolimus-Creme konnte in einer europäischen Dosisfindungsstudie (Maximaldosis 1,0 %) für die 0,6%ige und 1,0%ige Formulierung eine Wirksamkeit nachgewiesen werden. Niedrigere Formulierungen waren weniger wirksam. In dieser Studie waren alle getesteten Konzentrationen der Pimecrolimus-Creme weniger wirksam als das Betamethason-17-valerat 0,1 % (9).
Für die weitere Entwicklung wurde Pimecrolimus-Creme 1 % ausgewählt. In einer 12-monatigen Vergleichsstudie war Pimecrolimus-Creme weniger wirksam verglichen mit Triamcinolon Acetonid 0,1 %, einem mittelstarken Kortikosteroid (10). Etwa 60 % der Patienten aus der Pimecrolimusgruppe brachen die Studie vorzeitig ab, vor allem aufgrund mangelnder Wirksamkeit. Studienabbrecher waren daher hauptsächlich Patienten mit mittelschwerer und schwerer Form der AD. In nachfolgenden Studien wurde Pimecrolimus-Creme mit einer so genannten Standardtherapie verglichen, die aus einer Basispflege und Kortikosteroiden für einen Schub der Erkrankung bestand. In diesen Studien war Pimecrolimus wirksamer als eine Behandlung mit dem Vehikel allein (11-13). Eingeschlossene Patienten hatten milde bis mittelschwere Form der AD, bei etwa 25 % der Patienten war eine Behandlung ausschließlich mit dem Vehikel hinreichend. Kinder- und Erwachsenenstudien zeigten vergleichbare Ergebnisse: Pimecrolimus kann als Kortikosteroid einsparende Behandlung bei leichter bis mittelschwerer AD eingesetzt werden. Pimecrolimus-Creme ist daher in den USA und in Europa nur für die leichte bis mittelschwere AD zugelassen worden.
Das Profil der unerwünschten Arzneimittelwirkungen der Pimecrolimus-Creme ist vergleichbar der Tacrolimus-Salbe. Das initiale Brennen scheint bei der Pimecrolimus-Creme weniger häufig zu sein. Eine systemische Exposition war in den Studien mit Pimecrolimus-Creme durchgängig niedrig.
Auch wenn ein direkter Vergleich zwischen Tacrolimus-Salbe und Pimecrolimus-Creme noch nicht vorliegt, so ist eine höhere Wirksamkeit der Tacrolimus-Salbe unbestritten. Dies zeigt sich in den Ergebnissen der oben erwähnten Studien. Tacrolimus-Salbe kann als Monotherapie auch bei schwereren Formen der AD erfolgreich eingesetzt werden. Pimecrolimus-Creme dagegen ist nur bei leichten Formen der AD als Monotherapie einsetzbar. Grundsätzlich sollte die Monotherapie einer Kombinationstherapie von TIM und Kortikosteroiden vorgezogen werden, da langfristige Ergebnisse mit einer Monotherapie überlegen sind. Zusammenfassend können TIM topische Kortikosteroide als Behandlung der ersten Wahl herausfordern.
Literaturnachweis:
(1) Ruzicka
T. et al.
A short-term trial of tacrolimus ointment for atopic dermatitis.
N Engl J Med 337, 816-21,1997
(2) Boguniewicz M. et al.
A randomized,
vehicle-controlled trial of tacrolimus ointmenty for the treatment of atopic dermatitis
in children.
J Allergy Clin Immunol 102, 637-44, 1998
(3) Hanifin J.M.
et al.
Tacrolimus ointment in the treatment of atopic dermatitis in adult
patients: part I, efficacy.
J Am Acad Dermatol 44, 28-38, 2001
(4) Paller
A. et al.
A 12-week study of tacrolimus ointment for the treatment of atopic
dermatituis in pediatric patients.
J Am Acad Dermatol 44, 47-57, 2001
(5) Reitamo S. et al.
Efficacy and safety of tacrolimus ointment compared
with that of hydrocortisone butyrate ointment in adult patients with atopic dermatitis.
J Allergy Clin Immunol 109, 547-55, 2002
(6) Reitamo S. et al.
Efficacy
and safety of tacrolimus ointment compared with that of hydrocortisone acetate
ointment in children with atopic dermatitis.
J Allergy Clin Immunol 109,
539-46, 2002
(7) Reitamo S. et al.
Safety and efficacy of 1 year of tacrolimus
ointment monotherapy in adults with atopic dermatitis.
Arch Dermatol 136,
999-1006, 2000
 
|
Copyright
© 2000 - 2025
Institute for Dermopharmacy GmbH
webmaster@gd-online.de
Haftungsausschluss